GCPセンター
臨床研究とは
臨床研究とは、患者さんにご協力頂き、病気の原因の解明、病気の予防・診断・治療の改善など、ヒトを対象として行われるすべての研究のことを言います。その中で、医薬品や医療機器、外科的手技などの治療を試験的に施し、有効性や安全性を調べるのが「臨床試験」です。臨床試験の中でも「医薬品の臨床試験の実施の基準に関する省令(GCP)」に基づき治験審査委員会で審査されて行われるものが「治験」、「臨床研究法」に基づいて臨床研究審査委員会で審査されるものが「特定臨床研究」です。それ以外の「臨床研究」に関しては、「人を対象とする生命科学・医学系研究に関する倫理指針」に基づいて倫理審査委員会で審査されます。
治験とは
国(厚生労働省)から新しい薬(医薬品)として承認を得るために、健康な人や患者さんの協力を得て行われる臨床試験のことを『治験』、この時に使われる『薬の候補』を『治験薬』と呼びます。
新しい薬の開発を行う場合、まず『薬の候補』になる物質を選び出し、動物において『薬の候補』 の効果と安全性を調べます。動物において効果と安全性が確認できた場合には、次に健康な人や患者さんに『薬の候補』を使用していただいて、その効果と安全性を調べます。
このように、『薬の候補』が薬として実際に患者さんに使われるようになるまでには、その『薬の候補』に病気に対して効果があるかどうか、また安全であるかどうかを確かめた上で、国から薬として承認を得る必要があります。
治験の流れ
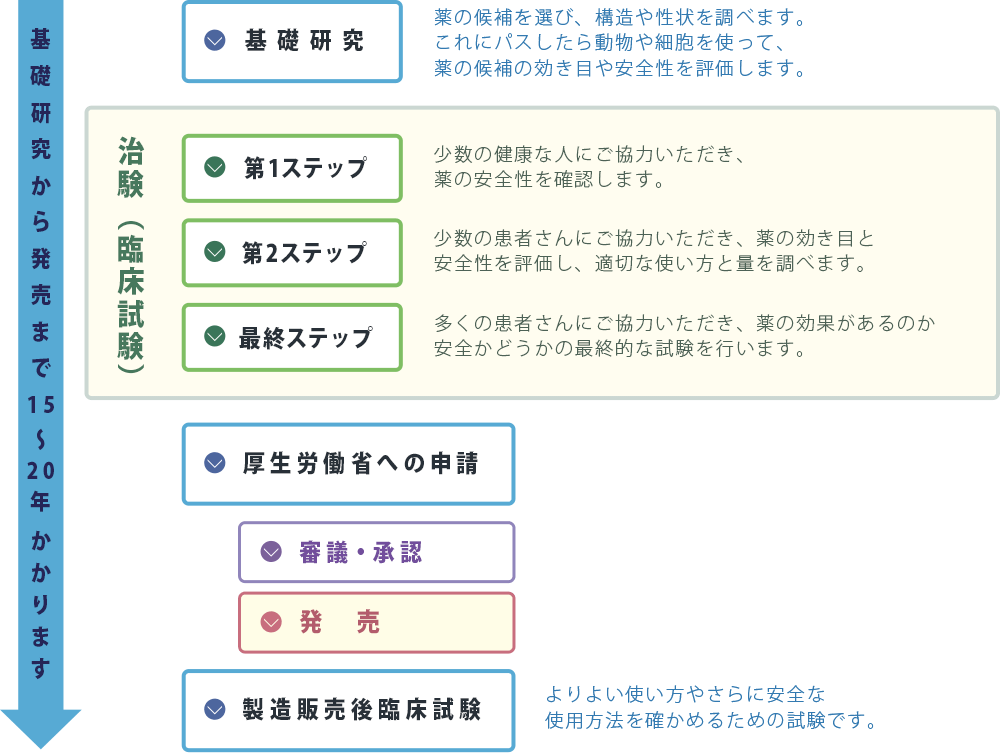
『治験』には研究的な側面がありますが、現在、あなたを含め他の多くの患者さんに使われている薬は、これまで『治験』に参加していただいた多くの方々の協力により生まれています。
治験を行う場合には、治験に参加される方々の安全と人権を守るために、国が定めた「医薬品の臨床試験の実施の基準(GCPといいます)」を遵守しなければなりません。
当院ではこのGCPに従って、科学的および倫理的な観点から、治験の実施や継続について調査・審議するため、順天堂大学医学部附属静岡病院治験審査委員会を設けています。
本治験審査委員会により内容が審議され、病院長より許可された治験のみが実施されています。
企業の方へ
生命科学・医学系指針の臨床研究
国が定めた「人を対象とする生命科学・医学系研究に関する倫理指針」に基づいて計画され、医学系研究等倫理委員会等において、研究の倫理性と科学性について審議、また承認を受けた後に実施される研究を生命科学・医学系指針下の「臨床研究」といいます。
臨床研究の中には、(1)患者さまやご家族に研究の内容を直接ご説明し、十分にご理解いただき、その上で同意をいただく場合と、(2)患者さまやご家族に直接同意を頂きませんが、研究の情報を公開することによって研究協力への拒否の機会を保障する場合(このような手法をオプトアウトという)があります。
臨床研究に関する情報公開
研究への協力を希望されない場合は、下記リンク内に記載されている各研究の担当者までお知らせください。なお、協力を希望されない旨の申し出があった場合でも、患者さんの診療に何ら影響することはなく、診療上の不利益をこうむることはありません。
なお、研究成果を学会や学術誌等で発表する場合、利用する情報から氏名や住所等の患者さんを直接特定できる個人情報は完全に削除し、患者さんを特定できない形で行います。
当院で実施中のオプトアウト対応の臨床研究は、下記リンクよりご覧ください。





